Mẹo giải nhanh câu hỏi trắc nghiệm môn Hóa đạt điểm cao (phần 1)
Để đạt điểm cao môn Hóa thi THPT QG ngoài việc các bạn sĩ tử cần phải trau dồi kiến thức đầy đủ thì các bạn cần phải giữ bình tĩnh và rèn luyện thật tốt kĩ năng phân tích đề bài điều này sẽ giúp ích các bạn rất nhiều trong khi làm bài thi.
Vì vậy hôm nay Yolearn sẽ chia sẻ các mẹo giúp các bạn xử đẹp môn Hóa oái om này tự tin làm chủ đề thi, giảm áp lực căng thẳng, gỡ rối những câu hỏi lừa dễ mắc sai lầm, có thể chọn trúng đáp án khi thời gian làm bài sắp hết.
Chủ đề hot trong tuần: Những lỗi sai học sinh dễ mắc phải khi làm bài thi môn Vật Lí THPT QG

Mẹo giải nhanh câu hỏi trắc nghiệm môn hóa học
Mẹo 1: Mỗi câu hỏi có 4 đáp án nhưng thường sẽ có 3 câu na ná giống nhau. 1 trong 3 chắc chắn là đáp án đúng, có thể loại ngay đáp án còn lại:
Ví dụ :
A. Chu kỳ 4, nhóm IIA
B. Chu kỳ 4, nhóm VIIIB
C. Chu kỳ 3, nhóm VIB
D. Chu kỳ 4, nhóm VIIIA
Ở đây thấy ngay đáp án C khác hẳn với các đáp án còn lại (có chữ Chu kỳ 3), nó sẽ là đáp án sai.
Đây là cách “làm nhiễu” rất phổ biến trong đề thi môn Hóa và các môn khác để thí sinh không thể chọn được ngay 1 đáp án chỉ với việc tính 1 dữ kiện. Bởi vậy xung quanh đáp án đúng sẽ có 1 vài đáp án giống nó. Và đáp án khác biệt nhất chắc chắn là đáp án sai.
Giải hóa nhanh bằng phương pháp loại trừ
Mẹo 2: Đáp án bị loại ngay lập tức sẽ thường có 1 phần đúng
Vẫn với ví dụ trên, đáp án C bị loại mang phần sai là “chu kỳ 3″, vậy thì phần “nhóm VIB” của nó sẽ là phần đúng. Vì vậy bạn có thể chọn đáp án nào giống (hoặc gần giống) với phần đúng này trong 3 đáp án còn lại.
Trong ví dụ trên, bạn có thể khoanh ngay đáp án B. Vì nó có phần cuối khá giống, với chữ …B.
Ta cùng phân tích một ví dụ khác
A. 4,9 và glixerol
B. 4,9 và propan-1,3-điol
C. 9,8 và propan-1,2-điol
D. 4,9 và propan-1,2-điol
Loại ngay đáp án C vì có phần “9,8” khác với những đáp án còn lại, đi cùng với nó là “propan-1,2-điol”, vậy dữ kiện đúng là “propan-1,2-điol”.
Từ đây suy ra D là đáp án đúng
►Hệ thống hóa kiến thức hóa học THPTQG
►Tổng hợp phương phải giải bài tập hóa học THPTQG
►Chữa đề thi thử môn hóa học THPTQG 2019 - Sở GĐ&ĐT Hà Nội
Mẹo 3: Dữ kiện nào xuất hiện nhiều lần trong các đáp án thường thì dữ kiện đó là dữ kiện đúng.
Ví dụ
A. Zn(NO3)2 và Fe(NO3)2
B. Zn(NO3)2 và AgNO3
C. Fe(NO3)2 và AgNO3
D. Fe(NO3)3 và Zn(NO3)2
Dễ thấy Zn(NO3)2 xuất hiện 3 lần ở các đáp án A, B và D, vậy 1 trong 3 đáp án này là đúng.
Áp dụng cùng với mẹo thứ hai ở trên, đáp án C bị loại sẽ có 1 phần đúng, vậy phần đúng đó có thể là Fe(NO3)2 hoặc AgNO3. Từ đây suy ra đáp án A hoặc B đúng. Bạn đã thu hẹp phạm vi đáp án lại rồi đấy. Cơ hội chọn lựa lúc này là 50:50, nhưng vẫn tốt hơn là 1:3 nên xác suất đúng sẽ cao hơn nhiều
Cùng phân tích một ví dụ khác:
A. Al, Fe, Cr
B. Mg, Zn, Cu
C. Ba, Ag, Au
D. Fe, Cu, Ag
Đếm số lần xuất hiện của dữ kiện thì thấy : Al, Zn, Au, Ba, Al xuất hiện 1 lần trong 4 đáp án. Nhưng Fe, Cu, Ag thì xuất hiện những 2 lần.
Vậy đáp án D. Fe, Cu, Ag là đáp án đúng.

Đạt điểm cao môn hóa học kì thi THPT QG không còn là khó
Mẹo 4: 2 đáp án nào gần giống nhau thì 1 trong 2 thường đúng
A. m = 2a – V/22,4
B. m = 2a – V/11,2
C. m = 2a – V/5,6
D. m = 2a + V/5,6
C hoặc D sẽ là đáp án đúng vì khá giống nhau
Loại D vì 3 đáp án còn lại đều xuất hiện dấu – còn 3 đáp án còn lại đều xuất hiện dấu +
Vậy đáp án ta chọn sẽ là C.
Nếu thấy 2-3 đáp án có liên quan mật thiết tới nhau như “gấp đôi nhau”, “hơn kém nhau 10 lần”, thì 1 trong số chúng sẽ là đáp án đúng. Cách này giúp bạn khoang vùng sự lựa chọn rất hữu hiệu
Vd : A. 15 B. 20 C. 13,5 D. 30
Dễ thấy 30 gấp đôi 15, vậy 1 trong 2 sẽ là đáp án đúng.
Mẹo 5: Nếu các đáp án xuất hiện %, những đáp án nào cộng với nhau bằng 100% thường là đáp án đúng
VD: A. 40% B.60% C. 27,27% D.50%
Dễ thấy 40% + 60% = 100%, vậy A hoặc B là đáp án đúng.
II. Bài toán về dãy điện hóa kim loại: chỉ cần nhớ những nguyên tố hay gặp
—— > Chiều tăng tính oxi hóa
K+ Na+ Mg2+ Al3+ Cr2+ Zn2+ Fe2+ Pb2+ H+ Cu2+ Fe3+ Ag+
—————————————————————————————- >
K Na Mg Al Cr Zn Fe Pb H2 Cu Fe2+ Ag
—— > Chiều giảm tính khử
An+ Bn+ Fe2+ Cu2+ Fe3+ Ag+
A B Fe Cu Fe2+ Ag
=> Quy tắc alpha cho các PỨ (rất hay gặp trong toán)
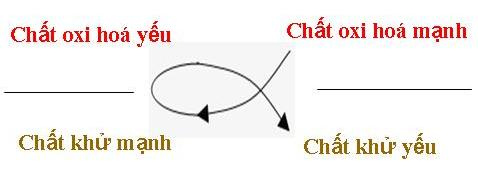
Quy tắc Alpha trong dãy điện hóa kim loại
1) Dạng toán: kim loại Fe/ Cu cho vào d/d AgNO3:
Fe + 2Ag+ -> Fe2+ + 2Ag
và Fe2+ + Ag+(dư) -> Fe3+ + Ag. => Fe + 3Ag+ -> Fe3+ + Ag
Hay: Cu + Ag+ -> Cu2+ + Ag
2) Trường hợp lưu ý:
Fe + Fe3+ -> Fe2+ (Fe + FeCl2 -> FeCl3) (Cr cũng vậy nhưng ít gặp)
3) Giữa Fe3+ và Cu (không tạo kết tủa): Cu + Fe3+ -> Cu2+ + Fe2+ (hay là có Cr3+)
Về toán: cho Cu vào d/d Fe(NO3)2. Đề hỏi những cái liên quan như khối lượng tăng thêm là bao nhiêu? Áp dụng: A = (64-56) * nPỨ = 8 *nPỨ với A là độ tăng thêm.
Ví dụ:
a) Ngâm đinh sắt trong 100ml dd CuCl2 1M, giả thiết Cu tạo ra bám hết vào đinh sắt. Sau khi phản ứng xong lấy đinh sắt ra sấy khô, khối lượng đinh sắt :
A. 15,5g. B. 2,7g. C. 2,4g. D. 0,8g.
Áp dụng: 8 *nPỨ = 8 * nCuCl2 = 8 * 1 * (100/1000) = 0,8g (nPỨ: số mol chất PỨ)
b) Ngâm một đinh sắt sạch trong 200ml dung dịch CuSO4 sau khi PỨ kết thúc, lấy đinh sắt ra khỏi dung dịch rửa nhẹ, làm khô nhận thấy khối lượng đinh sắt tăng . Tính nồng độ mol/lít CuSO4.
Áp dụng: 8 *nPỨ = 0,8 nPỨ = nCuSO4 = 0,1mol
=> [CuSO4] = n/V = 0,1/ (200/1000) = 0,5M. (nhớ đổi ml sang lít)
- Hết phần 1 -
Yolearn vừa điểm qua 5 mẹo sử dụng phương pháp loại trừ đáp án và các dạng toán liên quan đến "Dãy điện hóa của kim loại", lần tới sẽ gửi đến các bạn “Mẹo” giải câu hỏi trắc nghiệm môn Hóa đạt điểm cao (phần 2) các dạng toán liên quan đến:
1. Kim loại + H2SO4/ HCl loãng
2. Kim loại với axit HNO3 (đặc/ loãng)
3. Hỗn hợp kim loại X với axit HNO3 (đặc/ loãng) và yêu cầu tính khối lượng muối (hay muối rắn/ khan sau khi cô cạn) biết V lít khí sinh ra.
4. Hỗn hợp oxit kim loại + H2SO4 loãng (H2SO4 đặc khó hơn nên không đề cập). Tính lượng muối sunfat tạo thành.
5. Hỗn hợp oxit kim loại + CO/ H2. Tính khối lượng chất rắn/ kết tủa thu được.
6. Hỗn hợp muối cacbonat + HCl loãng. Tính khối lượng muối clorua tạo thành
Các bài viết phổ biến
-
 Hướng dẫn điều chỉnh nguyện vọng đăng ký xét tuyển đại học năm 2020
Hướng dẫn điều chỉnh nguyện vọng đăng ký xét tuyển đại học năm 2020
-
 Bộ GD&ĐT chính thức sửa đổi khung kế hoạch thời gian năm học
Bộ GD&ĐT chính thức sửa đổi khung kế hoạch thời gian năm học
-
 Đề thi, đáp án đề thi Tổ hợp Khoa học Xã hội - kì thi THPT QG 2019
Đề thi, đáp án đề thi Tổ hợp Khoa học Xã hội - kì thi THPT QG 2019
-
 Bộ GD-ĐT thông tin về thời gian đi học trở lại của cấp mầm non đến THCS
Bộ GD-ĐT thông tin về thời gian đi học trở lại của cấp mầm non đến THCS
-
 Cách tính điểm tốt nghiệp thi THPT QG 2020
Cách tính điểm tốt nghiệp thi THPT QG 2020
-
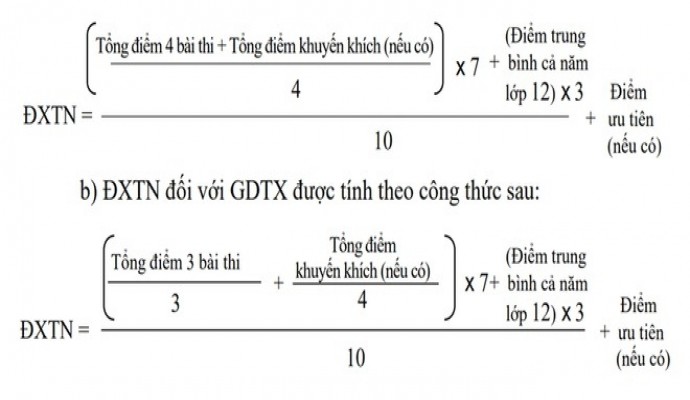 Cách tính điểm xét tốt nghiệp THPT năm 2020 - 2021
Cách tính điểm xét tốt nghiệp THPT năm 2020 - 2021











.gif)
